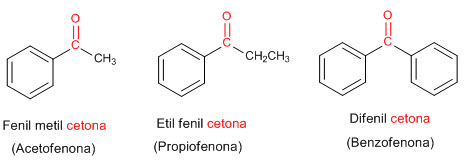
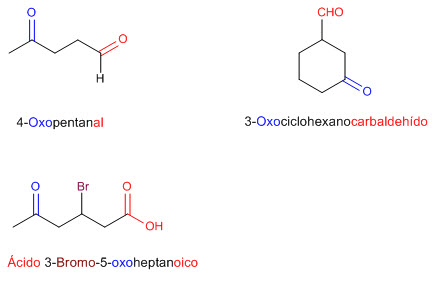
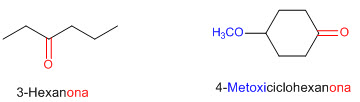ÁCIDOS CARBOXILICOS
USOS:
se utilizan los acidos carboxilicos:- emulsificantes
- se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.
- Además se usan como antitranspirantes y como neutralizantes
- Tambien para fabricar detergentes biodegradables,
- lubricantes y espesantes para pinturas.
- El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho;
- también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
PROPIEDADES FÍSICAS Y QUÍMICAS DE LOA ÁCIDOS CARBOXILICOS
propiedades físicas:
Los ácidos carboxílicos hierven a temperaturas muy superiores que los alcoholes, cetonas o aldehídos de pesos moleculares semejantes.
Los puntos de ebullición de los ácidos carboxílicos son el resultado de la formación de un dímero estable con puentes de hidrógeno.
Los ácidos carboxílicos que contienen más de ocho átomos de carbono, por lo general son sólidos, a menos que contengan dobles enlaces. la presencia de dobles enlaces (especialmente dobles enlaces cis) en una cadena larga impide la formación de una red cristalina estable, lo que ocasiona un punto de fusión más bajo.
Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los de peso molecular más pequeño (de hasta cuatro átomos de carbono) son miscibles en agua. a medida que aumenta la longitud de la cadena de carbono disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son esencialmente insolubles.
Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de hidrógeno con ellos.
Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los de peso molecular más pequeño (de hasta cuatro átomos de carbono) son miscibles en agua. a medida que aumenta la longitud de la cadena de carbono disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son esencialmente insolubles.
Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de hidrógeno con ellos.
propiedades químicas:
Aunque los ácidos carboxílicos contienen también al grupo carbonilo, sus reacciones son muy diferentes de las de las cetonas y los aldehídos. las cetonas y los aldehídos reaccionan normalmente por adición nucleofílica del grupo carbonilo, pero los ácidos carboxílicos y sus derivados reaccionan principalmente por sustitución nucleofílica de acilo, donde un nucleófilo sustituye a otro en el átomo de carbono del acilo (c=o).- Algunos son corrosivos
- son inflamables
BENEFICIOS:
- Actividad antimicrobiana
- Tiempo de vida útil aceptable
- Controla películas minerales
- No mancha


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)